耐热钢表面氧化膜的特性
耐热钢可以是低碳钢、低合金钢或高合金钢,因此其抗氧化性能与铁的氧化膜特性密切相关,而高温合金是以Fe、Ni或Co为基的合金。在实际应用中,Fe基合金的基体实际为Fe-Ni-Cr基,Co基合金大多为Co-Ni-Cr基,而Ni基合金实际为Ni-Cr或Ni-Cr-Co基,然后在此基础上进一步合金化,因此耐热钢的抗氧化性主要与基体元素Fe、合金元素Cr和Al等构成的氧化膜的特性有紧密联系。据此,以下将重点介绍Fe、Cr、Al的氧化膜特性。
1. 铁的氧化膜特性
图10.6给出了Fe-O状态图和氧化膜中氧化物的类型及分布。

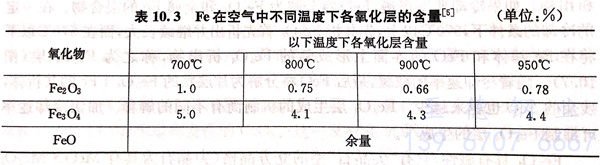
从图10.6可以看到,Fe与O可以生成三种稳定的氧化物;FeO(Wustite,维氏体)、Fe3O4(magnetite,磁铁矿)及Fe2O3(hemite,赤铁矿)。它们的分布如下:靠近基体-侧为FeO,中间层为Fe3O4,最外层为Fe2O3。各层氧化物的厚度或者三种氧化物是否同时存在取决于铁表面的氧化条件。随着温度的升高,各层氧化物的含量(质量分数)如表10.3所示。
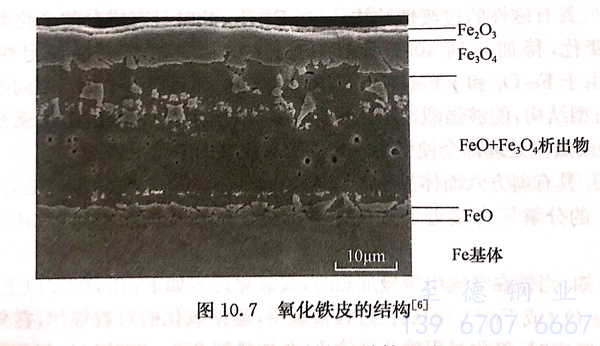
另外,在铁基体与FeO之间有一部分由氧和铁所形成的固溶体,在FeO与Fe3O4之间、Fe3O4与Fe2O3之间还各有一个中间层,这些中间层中含有相邻氧化物的混合物或固溶体。它们的各层结构如图10.7所示。
氧化亚铁FeO具有NaCl型的立方晶格,晶体学名称叫维氏体。由图10.6可知,维氏体在高于570~575℃时形成,而当它自高温冷下来时会发生4FeO→Fe+Fe3O4转变。维氏体中氧含量(原子分数)大于50%,过剩的氧在FeO中能够夺取部分铁的阳离子的电子(使Fe2+→Fe3+),过剩氧本身则以离子状态占据着阴离子结点,这样晶格中就有一部未占据的阳离子结点形成空位,维氏体的这种性质为Fe2+沿着空位移动、电子的转移(Fe2+-e→Fe3+-e)创造了条件,这两个方面的原因造成了铁在约600℃时开始强烈氧化的条件。
FeO能存在的最高温度为1424℃.在FeO存在区间有很宽的氧浓度的变化,当它自高温冷下来时,在共析点靠近Fe基体的一侧氧浓度变化很小,几乎看不到先共析Fe粒子的析出,而在靠近Fe3O4的一侧,则有相当数量的先共析Fe3O4的析出,析出物的析出速率很快。试样在980℃氧化后,即使水冷也不能阻止其在FeO中的析出,析出主要在靠近Fe3O4层的一侧。FeO冷却至约570℃以下将发生4FeO→Fe+Fe3O4的共析转变。
室温氧化铁皮的组织结构,随自高温开始冷却的温度和速率的不同而有很大的差异。冷却速率很快,高温形成的FeO将保留至室温,其中分布着一些Fe3O4析出物。如果冷却速率很慢,FeO将分解为Fe3O4和金属Fe的混合物。在一定的冷却的条件下,570℃以上,先共析Fe3O4首先析出并继续长大,而在570℃以下将在Fe基体和FeO的界面上形成新的Fe3O4析出物,称之为Fe3O4层(图10.7).随着冷却速率的减缓,最后FeO将分解为片层状的Fe3O4+Fe的共析体,残余的FeO也越来越少。Fe3O4层生成的机制尚有不同的解释。加快冷却速率可抑制Fe3O4层的生成。
Fe3O4具有磁性,它有“尖晶石”型的立方晶格(尖晶石为具有MeO·Me2O3型分子式和类似立方晶格的矿石,二价的金属Me2+可以是Mg、Fe、Mn与Zn,三的金属Me3+可以是Fe、Cr、Al等)。磁性Fe3O4从室温至熔点1597℃都是稳定在具有氧化性的介质中加热时有4Fe3O4+O2→6Fe2O3的转变发生,在C时形成具有磁性的过渡性结构-y-Fe2O3,此时只有成分的变化而没有晶结构的变化,待加热到400~500℃时才失去磁性而转变成稳定性结构的α-Fe2O3。由于Fe3O4和γ-Fe2O3堆砌得比较紧密,而且有各个结点之间距离比较小的尖晶石型结构,能够强烈地阻止扩散,故具有一定的抗氧化性,这就是温度小于575℃时或蒸汽处理都会使钢有一定的抗氧化性的原因。
a-Fe2O3具有斜方六面体晶系的结构,在高于1100℃时它将部分地分解,因为此时Fe2O3的分解压力接近于大气中氧的分压。在铁的熔点时,Fe2O3将完全分解。
由上可知,当铁在空气中缓慢加热时,其氧化过程如下:在200℃以下加热时,氧化膜γ-Fe2O3(或Fe3O4)的成长过程很缓慢,遵循氧化的对数规律,在氧化膜达到比较小的厚度时,氧化过程就几乎停止;在加热到250~275℃时,氧化膜的外层发生γ-Fe2O3(或Fe3O4)向α-Fe2O3的转变,氧化膜继续增厚;在加热到高于575℃时,已经生成三层氧化物-FeO-Fe3O4-α-Fe2O3,氧化过程大大加速,此时遵循抛物线规律。
2. 铬的氧化膜特性
合金元素Cr与O可以生成四种氧化物:CrO、Cr2O3、CrO2及CrO3.对耐热钢和高温合金而言,其中存在于低温下并具有立方结构的CrO与CrO2并不重要,而重要的是Cr2O3与CrO3。
CrO3为熔点较低的暗红色晶体,热稳定性较差,加热到435℃时会通过反应式4CrO3→2Cr2O3+3O2↑发生分解,因此它在耐热钢与高温合金中也是不能稳定存在的。
Cr2O3属于六方晶系,熔点2024℃,是Cr的氧化物中唯一能够稳定存在的化合物。在耐热钢与高温合金中,由于合金元素Cr转变为Cr2O3的生成自由能较低而容易使Cr被选择性氧化,导致合金表层Cr的浓度降低而形成由表及里的浓度梯度。当合金内部Cr的扩散供给不能弥补由于Cr2O3氧化膜生成所消耗的Cr量时,Cr2O3层出现贫铬区而造成Cr2O3氧化膜减薄,最终导致Cr2O3氧化膜破损而失去保护作用。Wagner合金高温氧化理论给出了保护性Cr2O3氧化膜的再生条件,只有合金表层的Cr浓度大于形成连续Cr2O3氧化膜所需的Cr浓度临界值(1000℃以下Fe-Cr合金的临界值约为14%)时,才能保证Cr2O3氧化膜具有良好的抗氧化性,但是Cr2O3氧化膜在高温下会进一步氧化,通过反应式2Cr2O3+3O2→4CrO3(g)生成挥发性的CrO3.这一反应在950℃以上就十分快速,因此Cr2O3氧化膜的使用温度不适于超过1000℃。
3. 铝的氧化膜特性
铝的氧化物只有一种,即Al2O3,它有四种同素异形体,即xAl2O3、β-Al2O3、γ-Al2O3和8-Al2O3,其中最主要的是x-Al2O3和γ-Al2O3.在含有水分的氧化性气氛中,将最终生成具有保护作用的xAl2O3氧化膜。-Al2O3的晶体结构与Cr2O3相似,同属六方晶系,熔点2040℃,热稳定性非常高,它不会随温度的升高而产生挥发性的组分,加之其氧化膜致密,因而在高温下Al2O3氧化膜的抗氧化能力比Cr2O3氧化膜强,但一般认为Al2O3氧化膜与基体的结合力比Cr2O3氧化膜稍差。由于Al2O3氧化膜的生成自由能比Cr2O3氧化膜的生成自由能低,因而Al2O3氧化膜的形成比Cr2O3氧化膜的形成更为容易,当Al和Cr共存时,只要动力学条件满足,Al2O3氧化膜将优先形成。含有适当量Al的耐热钢和高温合金在高温下具有优良的抗氧化性。
耐热钢与高温合金在高温下同样会发生氧化,但怎样的氧化速率才能在工业上使用就涉及金属的抗氧化性标准。
发表评论:
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。













